В обзорной статье рассматриваются взаимосвязь этиологии, патогенеза и факторов риска мастопатии и рака молочной железы (РМЖ), патогенетическое лечение мастопатии, направленное на профилактику РМЖ.
Введение
Мастопатия — наиболее частое женское заболевание. По данным отечественных и зарубежных авторов, распространенность мастопатии во многих странах в женской популяции составляет 50–60%. Частота данной патологии имеет возрастные эпидемиологические особенности: в возрасте 13–20 лет мастопатия встречается редко, в 20–30 лет — у 20–30% женщин, в 30–40 лет — у 50–60%, в 41–50 лет — у 70–80%, в менопаузе — до 20% [1–3]. Частым симптомом мастопатии является циклическая масталгия, с которой в своей жизни сталкиваются 60–70% женщин [4]. В России в своей жизни испытывают масталгию около 25 млн женщин [1]. Мастопатии обычно подвержены женщины в репродуктивном возрасте, пик заболеваемости приходится на возраст 30–45 лет [5].
Хотя до настоящего времени отсутствует общепринятая терминология, единые принципы диагностики и лечения данной патологии, обычно к мастопатии относят все доброкачественные заболевания молочных желез (МЖ) [3, 5–7]. В отечественной и зарубежной литературе для определения данной патологии применяются термины «мастопатия», «фиброзно-кистозная болезнь», «фиброзно-кистозная мастопатия», «доброкачественная болезнь груди», «фиброаденоматоз», «дисгормональная гиперплазия МЖ», «доброкачественная дисплазия МЖ». В Национальном руководстве по маммологии выделяют диффузную мастопатию в виде 4 типов — с преобладанием железистого, фиброзного или кистозного компонента и смешанную; диффузно-узловую мастопатию; узловую мастопатию; доброкачественные узловые образования — фиброаденомы, кисты, липомы, листовидные фиброаденомы, атеромы, липогранулемы, гамартомы, сосудистые опухоли, галактоцеле [8].
Клинически мастопатия характеризуется масталгией, предменструальным напряжением и отеком МЖ, появлением диффузных и узловых уплотнений в ткани МЖ, патологическими выделениями из сосков. Как правило, масталгия, величина и консистенция уплотнений, отек связаны с менструальным циклом и усиливаются в предменструальный период. При маммографическом и эхографическом исследованиях в МЖ выявляются уплотнения, дуктэктазии, кисты. При гистологическом исследовании в ткани МЖ находят гиперплазию, атипическую гиперплазию эпителиальной ткани в протоковых и дольковых структурах, гиперплазию соединительной ткани. При клиническом исследовании проявления мастопатии обнаруживаются у 20% женщин; при маммографическом, эхографическом и гистологическом исследованиях — у 50% [6–8].
Мастопатия — обширная неоднородная группа доброкачественной патологии МЖ, различающаяся по своим клиническим, маммографическим, морфологическим проявлениям, а самое главное — по степени риска рака МЖ (РМЖ). Своевременная диагностика и лечение мастопатии чрезвычайно важны, т. к. борьба с данной патологией не только улучшает качество жизни, но и направлена на профилактику РМЖ.
Мастопатия и рак молочной железы
Мастопатию и РМЖ можно отнести к так называемым болезням цивилизации. Стандартизованная заболеваемость РМЖ на 100 тыс. женщин в Северной Америке, Северной Европе, Западной Европе и Австралии составляет соответственно 84,8, 90,1, 92,6 и 94,2, тогда как в Южно-Центральной Азии, Средней Африке, Центральной Америке и Восточной Азии — соответственно 25,9, 27,9, 38,3 и 39,2 [9]. В странах с высоким уровнем заболеваемости РМЖ более высока и распространенность мастопатии. В России РМЖ занимает первое место в структуре онкологической заболеваемости и смертности женщин, заболеваемость РМЖ неуклонно растет. В 2017 г. в России зарегистрировано 70 569 новых случаев РМЖ, что составило 21,1% в структуре онкологической заболеваемости женщин; стандартизованный показатель заболеваемости РМЖ составил 51,95 на 100 тыс. женщин, за 10 лет данный показатель вырос на 22,68% (рост на 2,02% в год) [10]. При этом мастопатия имеется у 50–60% российских женщин [1].
Главной причиной столь широкой распространенности мастопатии и РМЖ в экономически развитых странах является изменение акушерского портрета женщины. Если до середины ХХ в. менархе у девочек наступало примерно в 17 лет, а менопауза у женщин — в 40 лет, то сейчас — соответственно в 12–14 и 50–52 года. Если ранее женщины часто рожали и длительно кормили грудью, то сегодня большинство женщин рожают 1–2 детей. В результате период репродуктивного возраста женщины увеличился в 2 раза — в среднем с 20 до 40 лет, а количество менструальных циклов на протяжении жизни выросло в 4 раза — в среднем со 100 до 400; современная женщина испытывает значительно более длительное воздействие эстрогенов [11].
Существуют 4 группы доказательств связи мастопатии с РМЖ:
- у мастопатии и РМЖ общие факторы риска;
- патогенез мастопатии и РМЖ имеет общие черты, ключевую роль играют гиперэстрогения и гиперпролиферация протокового и долькового эпителия МЖ;
- при мастэктомии по поводу РМЖ в окружающей ткани часто обнаруживаются морфологические проявления мастопатии и предраковые изменения;
- в эпидемиологических исследованиях у больных РМЖ доказана связь с предшествующей мастопатией [12].
Общее в этиологии и патогенезе мастопатии и рака молочной железы
РМЖ — полиэтиологическое заболевание, к настоящему времени идентифицировано более 100 факторов риска РМЖ [8, 13–15], которые можно разделить на 8 групп (табл. 1). Мастопатия — также полиэтиологическое заболевание, ее факторы риска [2, 3, 16, 17] можно разделить на те же 8 групп. Основные факторы риска мастопатии и РМЖ приведены в таблице 1, и большинство факторов риска развития этих заболеваний совпадают.
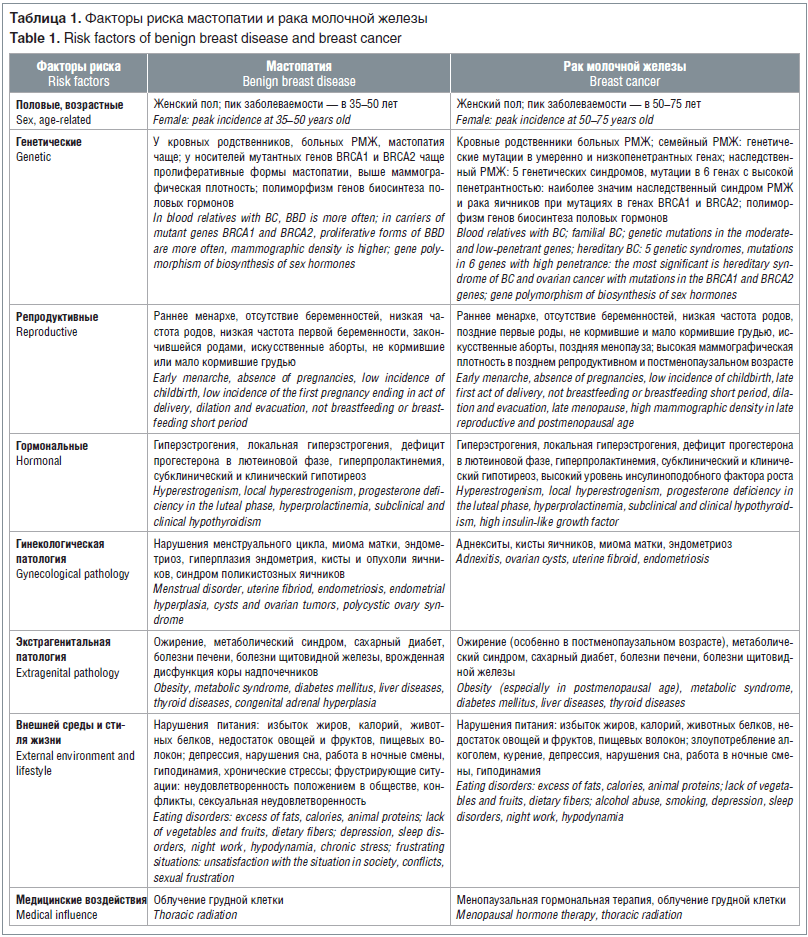
Хроническая гиперэстрогения, относительное преобладание эстрадиола и недостаток прогестерона на уровне ткани МЖ лежат в основе патогенеза как мастопатии, так и РМЖ; в результате эстрогены стимулируют пролиферацию эпителия МЖ [2, 6, 7]. Морфологические изменения при мастопатии постепенно прогрессируют. Гиперпролиферация эпителия протоков и долек приводит к диффузным уплотнениям, дуктэктазии, образованию кист, а разрастание соединительной ткани вызывает фиброз стромы; затем появляются очаговые узлы на фоне диффузной патологии; на следующей стадии трансформации в пролифератах появляются атипичные клетки [18]. К основным формам предраковых изменений МЖ относят протоковую атипичную гиперплазию эпителия и протоковую карциному in situ; дольковую атипичную гиперплазию эпителия и дольковую карциному in situ, склерозирующий аденоз, радиальный рубец, плоскую эпителиальную атипию [19].
При пролиферативных формах мастопатии в ткани МЖ формируются очаги с избыточным содержанием в эпителии эстрогеновых рецепторов, высокой активностью пролиферации и апоптоза клеток; наблюдаются увеличение содержания альфа-эстрогеновых рецепторов, изменение относительного содержания альфа- и бета-эстрогеновых рецепторов, A- и B-прогестероновых рецепторов; повышается чувствительность эпителия к эстрадиолу; активируется комплекс циклинзависимых киназ, альфа-трансформирующего и эпидермального факторов роста; усиливается пролиферативная активность эпителия; нарушаются процессы апоптоза; усиливается васкуляризация паренхимы. Все данные патологические механизмы повышают риск РМЖ [20].
Независимым и сильным фактором риска РМЖ является высокая маммографическая плотность в позднем репродуктивном и постменопаузальном возрасте, увеличивающая риск развития РМЖ в 3–6 раз, что существенно больше, чем значимость многих других факторов риска. Высокая маммографическая плотность уступает по степени повышения риска лишь возрасту, носительству мутантных генов BRCA и наличию предраковых изменений в ткани МЖ. Повышенная маммографическая плотность ассоциируется также с увеличением риска пролиферативной мастопатии и предраковых изменений в ткани МЖ [21].
Мастопатия и риск рака молочной железы
Мастопатия сама по себе является самостоятельным фактором риска РМЖ [8]. Даже один из симптомов мастопатии — длительная циклическая масталгия — независимо повышал риск РМЖ в 5,3 раза по сравнению с общепопуляционным риском [22]. Однако риск РМЖ при различных формах мастопатии сильно различается и зависит прежде всего от наличия гиперпролиферации эпителия и предраковых изменений в ткани МЖ. Был проведен метаанализ 32 эпидемиологических ретроспективных и проспективных исследований о связи мастопатии с риском РМЖ. Средний возраст пациенток в период выявления мастопатии при биопсии составил 46,1 года, средний возраст диагноза РМЖ — 55,9 года, средний срок наблюдения — 12,8 года (3,3–20,6); относительный риск РМЖ при непролиферативных формах мастопатии статистически недостоверно повышался до 1,17, при пролиферативных формах без атипии — статистически достоверно повышался до 1,76, при пролиферативных формах с атипией — до 3,93. Авторы делают заключение, что пролиферативные формы мастопатии как без атипии, так и с атипией значимо повышают риск РМЖ [23]. По данным R.J. Santen и R. Mansel, риск РМЖ не повышается или является минимальным при непролиферативных формах мастопатии, при пролиферативной мастопатии риск возрастает в 2 раза, при пролиферативной мастопатии с атипией — в 4 раза и достигает наиболее высоких цифр (до 12 раз) при протоковой или дольковой карциноме in situ [7]. Среди всей доброкачественной патологии МЖ непролиферативные формы мастопатии составляют примерно 70%, пролиферативные без атипии — около 30%, пролиферативные с атипией — 4–5% [16, 24].
Таким образом, мастопатию можно считать биомаркером гормонального неблагополучия на уровне организма и локального неблагополучия в ткани МЖ. Множественные факторы риска нарушают гормональный баланс в организме женщины, вызывают гиперэстрогению и гиперпролиферацию эпителия в ткани МЖ, что приводит к развитию мастопатии, а при наличии врожденных или приобретенных повреждений генов мастопатия повышает риск РМЖ. Всех женщин, страдающих мастопатией, нельзя относить к группе повышенного риска РМЖ. В группу повышенного онкологического риска женщины, страдающие мастопатией, могут быть включены после оценки всех индивидуальных факторов риска и морфологического анализа тканей МЖ.
Лечение мастопатии и профилактика рака молочной железы
Общепринятых стандартов лечения мастопатии на сегодняшний день нет. В лечении мастопатии применяются диетотерапия, психологическая коррекция, гормональные препараты, негормональные средства, такие как витамины, минералы, гепатопротекторы, мочегонные, ферментные препараты, иммунокорректоры, адаптогены, нестероидные противовоспалительные препараты, фитопрепараты [16, 25, 26]. К общим недостаткам большинства применяемых сегодня средств можно отнести невысокую эффективность, наличие побочного и токсического действия, необходимость применения в виде комплекса с другими средствами, нацеленность только на облегчение патологической симптоматики, а не на более серьезную задачу — профилактику РМЖ. С учетом характера данной патологии средства для лечения мастопатии должны быть эффективными, безопасными, подходящими для длительного применения, направленными на профилактику РМЖ. Патогенетическое лечение мастопатии относят к первичной профилактике РМЖ [27, 28].
В настоящее время для патогенетического лечения мастопатии существуют лишь единичные препараты. Лекарственный препарат Мамоклам® открывает новые перспективы в лечении мастопатии и профилактике РМЖ. Главное действующее вещество Мамоклама — йод в органической форме — влияет на основные патогенетические сдвиги при мастопатии. Йод накапливается в ткани МЖ при приеме в супрафизиологических дозах, нормализует процессы клеточной пролиферации в МЖ, снижает чувствительность эпителия МЖ к пролиферативным сигналам эстрогенов, оказывает антиоксидантное действие, снижает отечную готовность ткани МЖ, нормализует гормональный баланс [29, 30]. По данным эпидемиологических, клинических и экспериментальных исследований йод снижает риск РМЖ [31–34].
Высокая эффективность Мамоклама доказана в мультицентровом клиническом исследовании, проведенном в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России; ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России; Клинике женского здоровья — диагностическом центре г. Москвы [35–37]. Всего до конца исследований в трех клиниках были прослежены 95 больных. Все пациентки были позднего репродуктивного или пременопаузального возраста. У всех пациенток на момент включения в исследование был сохраненный менструальный цикл. Всем больным на основании клинического, эхографического и маммографического обследования МЖ был поставлен основной диагноз — диффузная мастопатия. Среди клинико-рентгенологических форм диффузной мастопатии наиболее частой была смешанная, затем по частоте встречаемости у больных расположились формы с преобладанием кистозного компонента, железистого компонента и фиброзного компонента. У единичных больных на фоне диффузной мастопатии выявлено узловое образование или фиброаденома. Кроме мастопатии у всех пациенток были и другие факторы риска РМЖ, как правило, несколько у одной больной: генетические — РМЖ у кровных родственников; репродуктивные — раннее менархе, аборты, отсутствие родов, поздние первые роды, отсутствие кормления грудью; гормональные и обменные — нарушения менструального цикла в анамнезе; гинекологические заболевания в момент включения в исследование или в анамнезе: бесплодие, миомы матки, воспалительные заболевания придатков и матки, кисты яичников, эндометриоз, железистая гиперплазия эндометрия; ожирение, диффузный зоб, болезни печени.
Оценивали клиническую симптоматику мастопатии, характер менструального цикла, пальпаторные, эхографические и маммографические изменения в МЖ. Мамоклам® назначали по 2 таблетки 3 р./сут до еды в течение 3 мес. Сравнивались данные обследований до и после лечения. Все обследования проводили в первой половине менструального цикла. До начала лечения и ежемесячно оценивали клиническую симптоматику и характер менструального цикла, пальпаторные признаки мастопатии. По специально разработанной количественной шкале проводили оценку масталгии, предменструального напряжения МЖ, альгоменореи. При пальпации МЖ по специально разработанной шкале проводили количественную оценку уплотнений, определение степени распространения по квадрантам, выраженности уплотнений в каждом квадранте, болезненности при пальпации, выделений из сосков. Эхография выполнялась на аппаратах типа «ССД-650» механическим секторным датчиком 10 МГц. Маммография выполнялась на маммографах типа «Вертикс-М». Делались 4 снимка в прямой и боковой проекциях. Статистическую обработку результатов проводили стандартными статистическими методами с использованием точного метода Фишера.
Суммарные результаты изучения Мамоклама в трех клиниках представлены в таблице 2. В качестве контрольных цифр служили показатели частоты патологических симптомов в группе больных до проведения лечения. В графе «после лечения» приводится количество больных, у которых не наблюдали регрессию патологического симптома.
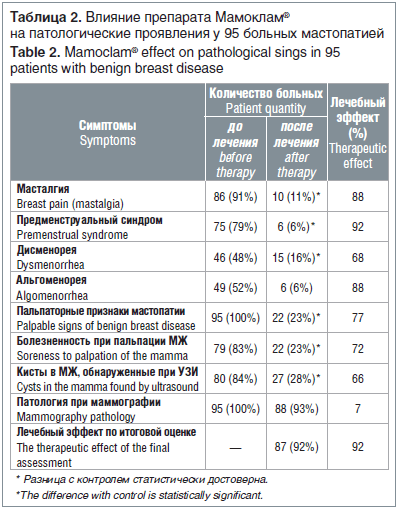
До лечения у большинства больных были жалобы на масталгию и предменструальное напряжение МЖ. В результате лечения Мамоклам® уменьшал проявления масталгии и предменструального синдрома соответственно у 88 и 92% пациенток. При этом более чем у половины больных наблюдали полную регрессию масталгии и предменструального синдрома. До лечения проявления дисменореи (продолжительность овариальных циклов более 28 дней и/или продолжительность менструаций более 5 дней, обильные менструации) были у 46 больных. Мамоклам® оказывал лечебное действие на проявления дисменореи у 67% пациенток, что выражалось в укорочении овариальных циклов, уменьшении продолжительности менструаций и ослаблении их обильности. До лечения явления альгоменореи отмечались у 49 больных. Мамоклам® приводил к полной или значительной регрессии альгоменореи у 88% пациенток. До лечения пальпаторные признаки мастопатии (уплотнения и отек в различных квадрантах) выявлены у всех больных, болезненность при пальпации МЖ — у 79. В результате лечения Мамокламом регрессия пальпаторных признаков мастопатии и полное или значительное исчезновение болезненности при пальпации наблюдались соответственно у 77 и 72% пациенток. При эхографическом исследовании до лечения у 80 больных выявлены кисты в МЖ. В результате лечения Мамокламом у 66% больных наблюдали полную или частичную регрессию одной или всех измеренных кист в МЖ. Все вышеназванные лечебные эффекты были статистически достоверны по сравнению с контролем. В результате лечения Мамокламом общий лечебный эффект наблюдался у 92% больных (табл. 2). У 7 пациенток, которым по показаниям провели повторное маммографическое исследование через 6 мес. от начала лечения Мамокламом, отмечено снижение маммографической плотности. Ни у одной больной не было общего ухудшения субъективных и объективных симптомов мастопатии. Во всех трех клиниках у Мамоклама не зарегистрированы клинически значимые побочные и токсические эффекты. Лишь у единичных больных отмечены симптомы индивидуальной непереносимости препарата.
Заключение
Мастопатия и РМЖ имеют общие факторы риска. Патогенез мастопатии и РМЖ имеет общие черты, ключевую роль играет гиперпролиферация протокового и долькового эпителия в результате гиперэстрогении. Метаанализ эпидемиологических исследований показал, что у пациенток с пролиферативными формами мастопатии и предраковыми изменениями существенно повышается риск РМЖ. Патогенетическое лечение мастопатии снижает риск РМЖ. Мамоклам® — лекарственный препарат для патогенетического лечения мастопатии с клинической эффективностью более 90%. Это негормональный препарат растительного происхождения, имеет благоприятный профиль безопасности, может применяться в течение длительного времени, подавляет гиперпролиферацию эпителия МЖ, приводит к регрессии кист в ткани МЖ, уменьшает маммографическую плотность и, следовательно, не только улучшает качество жизни больных мастопатией, но и снижает риск РМЖ.
Литература
1. Андреева Е.Н., Рожкова Н.И., Соколова Д.А. Доброкачественные дисплазии молочных желез: патогенетический вектор лечения. Обзор исследований, клинические рекомендации: информационный бюллетень. М.: Редакция журнала StatusPraesens. 2016:24.
2. Коган И.Ю., Мясникова М.О. Диагностика и лечение мастопатии. СПб.: Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, 2010:32.
3. Onstad M., Stuckey A. Benign breast disorders. Obstet Gynecol Clin North Am. 2013;40(3):459–473.
4. Kataria K., Dhar A., Srivastava A. et al. A Systematic review of current understanding and management of mastalgia. Indian J Surg. 2014;76(3):217–222.
5. Хамошина М.Б., Паренкова И.А. Не игнорировать мастопатию — не допускать рака. Новый вектор тактики при мастопатии: активная профилактика: информационное письмо. М.: Редакция журнала StatusPraesens. 2016:24.
6. Guray M., Sahin A.A. Benign breast diseases: classification, diagnosis, and management. Oncologist. 2006;11(5):435–449.
7. Santen R.J., Mansel R. Benign breast disorders. N Engl J Med. 2005;353(3): 275–285.
8. Каприн А.Д., Рожкова Н.И. Маммология: национальное руководство. М.: ГЭОТАР-Медиа, 2016:496.
9. GLOBOCAN 2018: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2018 (Электронный ресурс). URL: http://globocan.iarc.fr. (дата обращения: 19.11.2018 г.).
10. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена Минздрава России, 2018:250.
11. Беспалов В.Г. Новое в лечении мастопатии. Лечащий врач. 2007;(3): 92–93.
12. Семиглазов В.Ф., Семиглазов В.В., Клецель А.Е. Неинвазивные и инвазивные опухоли молочной железы. СПб., 2006:6–60.
13. Cintolo-Gonzalez J.A., Braun D., Blackford A.L. et al. Breast cancer risk models: a comprehensive overview of existing models, validation, and clinical applications. Breast Cancer Res Treat. 2017;164(2):263–284.
14. Семиглазов В.Ф., Семиглазов В.В. Рак молочной железы: биология, местное и системное лечение. М.: СИМК, 2014:352.
15. Kaminska M., Ciszewski T., Lopacka-Szatan K. et al. Breast cancer risk factors. Prz Menopauzalny. 2015;14(3):196–202.
16. Каприн А.Д., Рожкова Н.И. Доброкачественные заболевания молочной. М.: ГЭОТАР-Медиа, 2018:272.
17. Pearlman M.D., Griffin J.L. Benign breast disease. Obstet Gynecol. 2010;116(3):747–758.
18. Нейштадт Э.Л., Воробьева О.А. Патология молочной железы. СПб.: Фолиант, 2003:137–166.
19. Morrow M., Schnitt S.J., Norton L. Current management of lesions associated with an increased risk of breast cancer. Nat Rev Clin Oncol. 2015;12(4):227–238.
20. Беспалов В.Г., Травина М.Л. Фиброзно-кистозная болезнь и риск рака молочной железы (обзор литературы). Опухоли женской репродуктивной системы. 2015;11(4):58–70.
21. Беспалов В.Г., Негусторов Ю.Ф. Маммографическая плотность как критерий эффективности лечения мастопатии и снижения риска рака молочной железы. Опухоли женской репродуктивной системы. 2017;13(2):33–41.
22. Plu-Bureau G., Le M.G., Sitruk-Ware R., Thalabard J.C. Cyclical mastalgia and breast cancer risk: results of a French cohort study. Cancer Epidemiol Biomarkers Prev. 2006;15(6):1229–1231.
23. Dyrstad S.W., Yan Y., Fowler A.M., Colditz G.A. Breast cancer risk associated with benign breast disease: systematic review and meta-analysis. Breast Cancer Res Treat. 2015;149(3):569–575.
24. Socolov D., Anghelache I., Ilea C. et al. Benign breast disease and the risk of breast cancer in the next 15 years. Rev Med Chir Soc Med Nat Iasi. 2015;119(1):135–140.
25. Высоцкая И.В., Летягин В.П., Ким Е.А., Левкина Н.В. Практические рекомендации по лекарственной коррекции диффузной дисгормональной дисплазии молочных желез. Опухоли женской репродуктивной системы. 2014;(2):45–52.
26. Высоцкая И.В., Летягин В.П., Левкина Н.В. Гормональная терапия диффузной мастопатии. Опухоли женской репродуктивной системы. 2014;(3):53–57.
27. Рожкова Н.И., Меских Е.В., Бурдина Л.М. и др. Лекарственная патогенетическая коррекция доброкачественных заболеваний молочной железы. Опухоли женской репродуктивной системы. 2008;(2):48–54.
28. Чистяков С.С., Сельчук В.Ю., Гребенникова О.П. и др. Опухоли женской репродуктивной системы / под ред. С.С. Чистякова. М.: Медицинское информационное агентство, 2011:53–83.
29. Aceves C., Anguiano B., Delgado G. Is iodine a gatekeeper of the integrity of the mammary gland? J Mammary Gland Biol Neoplasia. 2005;10(2):189–196.
30. Aceves C., Anguiano B., Delgado G. The extrathyronine actions of iodine as antioxidant, apoptotic, and differentiation factor in various tissues.Thyroid. 2013;23(8):938–946.
31. Feldt-Rasmussen U. Iodine and cancer.Thyroid. 2001;11(5):483–486.
32. Shrivastava A., Tiwari M., Sinha R.A. et al. Molecular iodine induces caspase-independent apoptosis in human breast carcinoma cells involving the mitochondria-mediated pathway. J Biol Chem. 2006;281(28):19762–19771.
33. Anguiano B., Garcia-Solis P., Delgado G. et al. Uptake and gene expression with antitumoral doses of iodine in thyroid and mammary gland: evidence that chronic administration has no harmful effects. Thyroid. 2007;17(9):851–859.
34. Iodine Monograph. Alternat. Med. Rev. 2010;15(3):273–278.
35. Беспалов В.Г., Бараш Н.Ю., Иванова О.А. и др. Изучение лекарственного препарата Мамоклам для лечения больных с фиброаденоматозом молочных желез. Вопросы онкологии. 2005;51(2):241–246.
36. Беспалов В.Г. Мастопатия и лекарственный препарат Мамоклам. СПб.: Игра света, 2008:68.
37. Прилепская В.Н., Тагиева Т.Т. Фиброзно-кистозная болезнь молочных желез: возможности негормональной терапии. Медлайн экспресс. 2008;(5):10–18.
1. Andreeva E.N., Rozhkova N.I., Sokolova D.A. Benign breast dysplasia: a pathogenetic vector of treatment. Review of the research, clinical recommen-dations: Information bulletin. Moscow: Editorial Office of the Journal StatusPraesens, 2016:24 (in Russ.).
2. KoganI.Yu., Myasnikova M.O. Diagnosis and Treatment of Mastopathy. St. Petersburg: Acad. I.P. Pavlov St. Petersburg State Medical University, 2010:32 (in Russ.).
3. Onstad M., Stuckey A. Benign breast disorders. Obstet Gynecol Clin North Am. 2013;40(3):459–473.
4. Kataria K., Dhar A., Srivastava A. et al. A Systematic review of current understanding and management of mastalgia. Indian J Surg. 2014;76(3): 217–222.
5. Hamoshina M.B., Parenkova I.A. Do not ignore mastopathy — do not tolerate cancer. New vector of tactics in mastopathy: active cancer prevention: Information letter. Moscow: Editorial Office of the Journal StatusPraesens, 2016:24 (in Russ.).
6. Guray M., Sahin A.A. Benign breast diseases: classification, diagnosis, and management. Oncologist. 2006;11(5):435–449.
7. Santen R.J., Mansel R. Benign breast disorders. N Engl J Med. 2005;353(3):275–285.
8. Kaprin A.D., Rozhkova N.I. Mammology: National Guide. Moscow: GEOTAR-Media, 2016:496 (in Russ.).
9. GLOBOCAN 2018: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2018 (Electronic resource). URL: http://globocan.iarc.fr. (access date: 19.11.2018 г.).
10. Kaprin A.D., Starinsky V.V., Petrova G.V. Malignant Neoplasms in Russia in 2017 (morbidity and mortality). Moscow: P.A. Herzen Moscow Research Oncologic Institute of the Russian Ministry of Health, 2018:250 (in Russ.).
11. Bespalov V.G. What is new in treatment of mastopathy. Attending Physician. 2007;(3):92–93 (in Russ.).
12. Semiglazov V.F., Semiglazov V. V., Kletsel A.E. Noninvasive and Invasive Breast Tumors. St. Petersburg, 2006:6–60 (in Russ.).
13. Cintolo-Gonzalez J.A., Braun D., Blackford A.L. et al. Breast cancer risk models: a comprehensive overview of existing models, validation, and clinical applications. Breast Cancer Res Treat. 2017;164(2):263–284.
14. Semiglazov V.F., Semiglazov, V.V. Breast Cancer: Biology, Local and Systemic Treatment. Moscow: SIMK, 2014: 352 (in Russ.).
15. Kaminska M., Ciszewski T., Lopacka-Szatan K. et al. Breast cancer risk factors. Prz Menopauzalny. 2015;14(3):196–202.
16. Kaprin A.D., Rozhkova N.I. Benign Diseases of the Breast Moscow: GEOTAR-Media, 2018:272 (in Russ.).
17. Pearlman M.D., Griffin J.L. Benign breast disease. Obstet Gynecol. 2010;116(3):747–758.
18. Neishtadt E.L., Vorobyeva O.A. Pathology of the Breast. St. Petersburg: Foliant, 2003:137–166 (in Russ.).
19. Morrow M., Schnitt S.J., Norton L. Current management of lesions associated with an increased risk of breast cancer. Nat Rev Clin Oncol. 2015;12(4): 227–238.
20. Bespalov V.G., Travina M.L. Fibrocystic disease and breast cancer risk (а review of literature). Tumors of Woman,s Reproductive System. 2015;11(4):58–70 (in Russ.).
21. Bespalov V.G., NegustorovYu.F. Mammographic density as a criterion of the efficiency of treatment of benign breast disease and reducing risk of breast cancer. Tumors of Woman,s Reproductive System. 2015;11(4):58–70 (in Russ.).
22. Plu-Bureau G., Le M.G., Sitruk-Ware R., Thalabard J.C. Cyclical mastalgia and breast cancer risk: results of a French cohort study. Cancer Epidemiol Biomarkers Prev. 2006;15(6):1229–1231.
23. Dyrstad S.W., Yan Y., Fowler A.M., Colditz G.A. Breast cancer risk associated with benign breast disease: systematic review and meta-analysis. Breast Cancer Res Treat. 2015;149(3):569–575.
24. Socolov D., Anghelache I., Ilea C. et al. Benign breast disease and the risk of breast cancer in the next 15 years. Rev Med Chir Soc Med Nat Iasi. 2015;119(1):135–140.
25. Vysotskaya I.V., Letyagin V.P., Kim Ye.A., Levkina N.V. Practical guidelines for drug correction of diffuse dyshormonal dysplasia of the breast. Tumors of Woman,s Reproductive System. 2014;(2):45–52 (in Russ.).
26. VysotskayaI.V., LetyaginV.P., LevkinaN.V. Hormone therapy for diffuse mastopathy. Tumors of Woman,s Reproductive System 2014;(3):53–57 (in Russ.).
27. Rozhkova N.I., Meskikh E.V., Burdina L.M. et al. Medicinal pathogenetic correction of benign breast disease. Tumors of Woman,s Reproductive System. 2008;(2):48–54 (in Russ.).
28. Chistyakov S.S., Selchuk V.Yu., Grebennikova O.P. et al. Tumors of the Female Reproductive System. Ed. by S.S. Chistyakov. Moscow: Medical Information Agency, 2011:53–83 (in Russ.).
29. Aceves C., Anguiano B., Delgado G. Is iodine a gatekeeper of the integrity of the mammary gland? J Mammary Gland Biol Neoplasia. 2005;10(2): 189–196.
30. Aceves C., Anguiano B., Delgado G. The extrathyronine actions of iodine as antioxidant, apoptotic, and differentiation factor in various tissues.Thyroid. 2013;23(8):938–946.
31. Feldt-Rasmussen U. Iodine and cancer. Thyroid. 2001;11(5):483–486.
32. Shrivastava A., Tiwari M., Sinha R.A. et al. Molecular iodine induces caspase-independent apoptosis in human breast carcinoma cells involving the mitochondria-mediated pathway. J Biol Chem. 2006;281(28):19762–19771.
33. Anguiano B., Garcia-Solis P., Delgado G. et al. Uptake and gene expression with antitumoral doses of iodine in thyroid and mammary gland: evidence that chronic administration has no harmful effects. Thyroid. 2007;17(9):851–859.
34. Iodine. Monograph. Altern. Med. Rev. 2010;15(3):273–278.
35. Bespalov V.G., Barash N.Yu., Ivanova O.A. et al. Study of pharmaceutical drug mamoclam for the treatment of patients with benign breast disease. Problems in Oncology. 2005;51(2):241–246 (in Russ.).
36. Bespalov V.G. Mastopathy and Pharmaceutical Drug Mamoclam. St. Petersburg: Play of Light, 2008:68 (in Russ.).
37. Prilepskya V.N., Tagieva T.T. Fibrocystic disease of the mammary gland and possibilities of its non-hormonal treatment // Medline Express 2008;(5):10–18 (in Russ.).


 English
English